简介
钙在各种细胞中充当通用的第二信使。 生命的开始,受精的行为,是
由Ca2 +调节。 所有类型细胞的许多功能由Ca 2+或多或少地调节。 自从20世纪20年代,科学家们试图测量Ca2 +,但由于Ca2 +探针的有限性,很少有人成功。 首先Ridgway和Ashley通过将发光蛋白水母发光蛋白注射到巨人体内来进行可靠的Ca2 +测量藤壶的肌纤维。 随后,在20世纪80年代,Tsien及其同事制作了各种荧光指示剂。其中基于荧光素的Ca2 +试剂(如Fluo-3和Fluo-4)提供了值得信赖的方法。测量Ca2 +。 由于这些Ca2 +探针的发展,对Ca2 +的研究相关的细胞内现象已近飙升。
Fluo-8®钙指示剂,最亮的钙染料
自引入以来,Fluo-3成像及其类似物(如Fluo-4)揭示了Ca2 +信号传导中许多基本过程的空间动力学。 Fluo-3和Fluo-4也已广泛用于流式细胞术和基于微孔板(如FLIPR™)的钙检测。 然而,弱信号和苛刻的染料加载条件限制了它们在某些细胞分析中的应用。 我们开发了Fluo-8®系列钙检测试剂,以解决Fluo-3和Fluo-4的这些局限性。
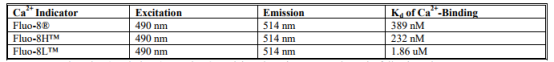
Fluo-3和Fluo-4在细胞应用中最重要的特性是它们的吸收光谱与氩离子激光源在488nm激发相容,并且响应Ca2 +结合的荧光强度增加非常大。我们的Fluo-8®Ca2+检测试剂保留了这两个有价值的特性。 Fluo-8®试剂的吸收峰和发射峰分别为490 nm和514 nm。它们可以用488nm的氩离子激光很好地激发,并且它们发射的荧光(波长514nm)随着Ca2 +的增加而增加。 Fluo-8®在与Ca2 +结合后确定荧光增加> 200倍。由于刺激后许多细胞中Ca2 +的增加范围通常为5至10倍,因此Fluo-8®是该区域中高灵敏度使用的优异探针.Fluo-8®的Kd估计为389 nM (22℃,pH7.0-7.5),但该值可能受pH,粘度和体内条件下结合蛋白的显着影响。
除了方便的488 nm激发波长和钙的大荧光增强外,Fluo-8®在细胞中比Fluo-3和Fluo-4更亮,如图1所示。此外,Fluo-8®更容易装入 比Fluo-3和Flu-4活细胞,两者都需要37°C才能获得最佳的细胞负载。 Fluo-8®试剂具有较低的温度依赖性细胞负载特性,在室温或37°C下也能得到相似的结果。 这一特性使Fluo-8®更适合HTS应用。
表1.Fluo-8®钙检测试剂的光谱和Ca2 +结合特性
与Fluo-3和Fluo-4相比,我们的Fluo-8®钙检测试剂具有以下优势:
·1、方便的波长:最大激发波长@ 490 nm; 最大发射@ ~514 nm。
·2、增强强度:比Fluo-4 AM亮2倍; 比Fluo-3 AM亮4倍。
·3、加载速度更快:在室温下加载染料(而不是Fluo-4 AM所需的37ºC)。
·4、多功能Ca2 + - 结合Kd,如表1所示。
·5、多功能包装尺寸,满足您的特殊需求:1毫克; 10x50μg; 20x50μg; HTS包。
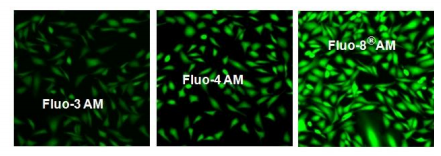
图1.将U2OS细胞以40,000个细胞/100μL/孔接种过夜,置于96孔黑色壁/透明底板中。 除去生长培养基,将细胞分别与37μC,5%CO2培养箱中的浓度为4μM的100μLFluo-3AM,Fluo-4AM和Fluo-8®AM在HHBS中孵育。 持续1小时。 将细胞用200μLHHBS洗涤两次,然后使用FITC通道用荧光显微镜(OlympusIX71)成像。
使用Fluo-8®AM酯类
1.使用Fluo-8®AM酯的称重传感器:
AM酯是非极性酯,其易于穿过活细胞膜,并且通过活细胞内的细胞酯酶快速水解。 AM酯广泛用于非侵入性地将各种极性荧光探针装载到活细胞中。 但是,使用AM酯时必须小心,因为它们易于水解,特别是在溶液中。它们应在使用前重新配制成高质量的无水二甲基亚砜(DMSO)。 DMSO储备溶液可以在-20℃下干燥储存并避光。 在这些条件下,AM酯应该稳定数月。
以下是我们推荐的将Fluo-8®AM酯加入活细胞的方案。 该步骤仅提供指南,应根据您的特定需求进行修改。
a)在高质量无水DMSO中制备2至5 mM Fluo-8®AM酯原液。
b)在实验当天,将Fluo-8®溶解在DMSO中或将等份的指示剂储备溶液解冻至室内温度。在Hanks和Hepes缓冲液(HHBS)或您的缓冲液中准备1到10μM的工作溶液选择0.02%Pluronic®F-127。对于大多数细胞系,Fluo-8®试剂的浓度范围为4-5 uM。细胞加载所需指示剂的确切浓度必须根据经验确定。避免因过载和潜在染料毒性引起的任何伪影,建议使用最小染料浓度可以产生足够的信号强度。
注意:非离子型洗涤剂Pluronic®F-127有时用于增加Fluo-8®AM的水溶性酯。各种Pluronic®F-127解决方案可从AAT Bioquest购买。
c)如果您的细胞含有有机阴离子转运蛋白,丙磺舒(1-2.5 mM)或磺吡酮(0.1-0.25 mM)可能是添加到细胞培养基中以减少脱酯化指示剂的泄漏。
注意:可以购买各种ReadiUse™丙磺舒,包括水溶性钠盐和稳定溶液
来自AAT Bioquest。
d)将等体积的染料工作溶液(来自步骤b或c)加入细胞板中。
e)将染料加载板在细胞培养箱或室温下孵育20分钟至1小时。
注意:降低加载温度可能会减少指示符的划分。
f)用您选择的HHBS或缓冲液替换染料工作溶液(含有阴离子转运蛋白抑制剂,如2.5 mM丙磺舒(如果适用)去除多余的探针。
g)在Ex / Em = 490 / 525nm处进行实验
2.测量细胞内钙响应:见图1。
使用Screen Quest™Fluo-8 NW钙测定试剂盒进行HTS应用
可以通过直接测量受体介导的cAMP积累或改变细胞内Ca 2+浓度来检测GPCR活化。通过Gq偶联的GPCR靶标产生细胞内Ca2 +的增加,可以使用Fluo-8 试剂和荧光酶标仪的组合测量。荧光成像平板读取器(例如,FLIPR ,FDSS或BMG NovoStar )具有冷却的CCD相机成像系统,其同时收集来自微孔板(96和384孔)的每个孔的信号。这些读板器可以亚秒间隔读取,这使得能够捕获响应的动力学,并且具有可以对连续液体添加进行编程的集成移液器。除了它们对GPCR靶标的强大应用外,我们的Screen Quest Fluo-8钙测定试剂盒也可用于表征钙离子通道和筛选钙离子通道靶向化合物。
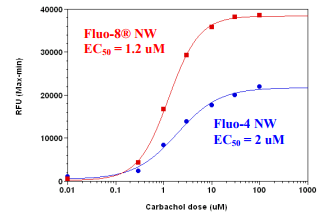
图2.使用Screen Quest Fluo-8 NW测定试剂盒和Fluo-4 NWAssay试剂盒在HEK-293细胞中测量卡巴胆碱剂量反应。将HEK-293细胞以40,000个细胞/100μL/孔接种过夜,置于96孔黑色壁/透明底板中。除去生长培养基,将细胞分别与100μL的Screen Quest一起孵育 ] Fluo 8-NWcalcium测定试剂盒和Fluo-4 NW试剂盒(根据制造商的说明书)在室温下保持1小时。通过NOVOstar(BMG LabTech)添加卡巴胆碱(25μL/孔)以达到最终指示的浓度。 Fluo-8NW的EC50约为1.2 uM。
与Fluo-3或Fluo-4的其他商业钙测定试剂盒相比,我们的Screen Quest钙测定试剂盒在HTS应用中具有以下优势:
·广泛的应用:与GPCR和钙通道目标一起使用。
·方便光谱波长:最大激发波长@ 490 nm;最大发射@ ~514 nm。
·灵活的染料负载:室温下染料负载(而不是Fluo-4 AM所需的37ºC)。
·无需清洗,无淬火干扰您的目标。
·强大的性能:启用钙测定使用Fluo-4 AM或Fluo-3 AM是不可能的。
·最强信号强度:比Fluo-4 AM亮2倍;比Fluo-3 AM亮4倍。
使用Fluo-8®盐
钙校准可以通过测量具有精确已知的游离Ca 2+浓度的溶液中的指示剂的盐形式(荧光微板读数器中25至50μM)的荧光强度来进行。 可以使用基于30mM MOPS EGTA Ca2 +缓冲液的校准溶液。 通常,水含有微量的钙离子。 强烈建议使用30 mM MOPS + 100 mM KCl,pH 7.2作为缓冲系统。 人们可以简单地制作如下所列的0和39μM钙原液,这两种溶液用于制备不同Ca2 +浓度的连续溶液
A. 0 µM calcium: 30 mM MOPS + 100 mM KCl, pH 7.2 buffer + 10 mM EGTA
B. B. 39 µM calcium: 30 mM MOPS + 100 mM KCl, pH 7.2 buffer + 10 mM EGTA + 10 mM CaCl2
要确定溶液的游离钙浓度或单波长钙指示剂的Kd,使用以下等式:
[Ca]free = Kd[F ─ Fmin]/Fmax ─ F]
其中F是在特定实验钙水平下指示剂的荧光强度,Fmin是不含钙时的荧光强度,Fmax是钙饱和探针的荧光强度。
解离常数(Kd)是探针对钙的亲和力的量度。与校准溶液相比,荧光指示剂的钙结合和光谱特性在细胞环境中变化非常显着。细胞内指标的原位反应校准通常产生显着高于体外测定的Kd值。通过在存在的离子载体如A-23187,4-溴A-23187和离子霉素的情况下将加载的细胞暴露于受控的Ca2+缓冲液来进行原位校准。或者,细胞透化剂如digitoninor Triton X-100可用于将指示剂暴露于细胞外培养基的受控Ca2 +水平。Fluo-8试剂的Kd值列于表1中供您参考。
结论
由于Ca2+在生物学中的重要性,已经建立了许多用于分析细胞和/或亚细胞Ca 2+活性机制的技术/方法。然而不幸的是,没有一种可以测量Ca 2+的最佳技术/方法。 尽管用于分析Ca2+活性的每种方法都具有优于其他方法的某些优点,但每种方法也存在缺点。凭借上述出色的性能,我们相信Fluo-8®钙检测试剂和Screen Quest™Fluo-8NW钙测定试剂盒为各种生物系统中的细胞内钙分析和监测提供了新的强大工具,与荧光仪器的快速发展相结合。
正如可能预测的那样,许多研究人员的兴趣从细胞水平的Ca2 +分析转向亚细胞水平。 已经发现Ca2 +在整个细胞中均匀分布,并且在多种细胞(例如,卵母细胞,心肌细胞,肝细胞和外分泌细胞)中观察到Ca2 +的细胞内异质性(例如Ca2 +波和Ca2 +火花)。)。 随着20世纪80年代共聚焦激光扫描显微镜(CLSM)和2000年代先进的酶标仪(如FLIPR,FDSS和NOVOStar专用于细胞内Ca2 +检测)的出现,细胞内Ca2 +的测量显着加速。 共聚焦激光扫描显微镜,以及最近的多光子显微镜,除了测量其浓度外,还允许在亚细胞水平上对细胞内Ca 2+活性进行精确的空间和时间分析。
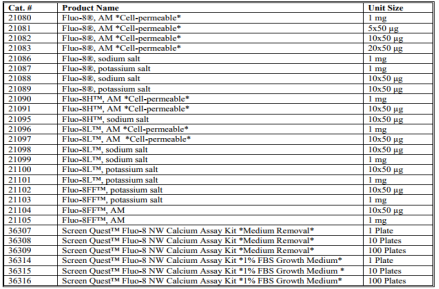
产品列表
参考文献
1. Alkhaldi, Jan Martinek , Brian Panicucci, Christophe Dardonville, Alena Zíkova, Harry P. de Koning. Trypanocidal action of bisphosphonium salts through a mitochondrial target in bloodstream form Trypanosoma brucei. International Journal for Parasitology: Drugs and Drug Resistance 6 (2016) 23e34.
2. Takahiro Shibata, Katsuhiro Takahashi, Yui Matsubara, Emi Inuzuka, Fumie Nakashima, Nobuaki Takahashi, Daisuke Kozai, Yasuo Mori & Koji Uchida. Identification of a prostaglandin D2 metabolite as a neuritogenesis enhancer targeting the TRPV1 ion channel. Sci Rep. 2016; 6: 21261. Published online 2016 Feb 16. doi: 10.1038/srep21261. 3. Boris Gourévitchh, Jun Cai, Nicholas Mellen. Cellular and network-level adaptations to in utero methadone exposure along the ventral respiratory column in the neonate rat. Experimental Neurology. Available online 20 March 2016.
3. Aditya J. Desai, Maoqing Dong, Laurence J. Miller. Beneficial effects of β-sitosterol on type 1 cholecystokinin receptor dysfunction induced by elevated membrane cholesterol. Clinical Nutrition. Available online 15 March 2016.
4. Wiktor S. Phillips, Mikkel Herly, Christopher A. Del Negro, and Jens C. Rekling . Organotypic slice cultures containing the preBötzinger complex generate respiratory-like rhythms. J Neurophysiol. 2016; 115:1063-1070.
5. Jin-Feng Zhao, Song-Kun Shyue, and Tzong-Shyuan Lee. Excess Nitric Oxide Activates TRPV1-Ca2+ -Calpain Signaling and Promotes PEST-dependent Degradation of Liver X Receptor α. Int J Biol Sci. 2016; 12(1): 18–29. doi: 10.7150/ijbs.13549.
6. Robert A. Volkmann, Christopher M. Fanger, David R. Anderson, Venkata Ramana Sirivolu, Kathy Paschetto, Earl Gordon, Caterina Virginio, Melanie Gleyzes, Bruno Buisson, Esther Steidl, Susanna B. Mierau, Michela Fagiolini, Frank S. Menniti . MPX-004 and MPX-007: New Pharmacological Tools to Study the Physiology of NMDA Receptors Containing the GluN2A Subunit. Plos one. Published: February 1, 2016. http://dx.doi.org/10.1371/journal.pone.0148129.
7. Retsu Mitsui , Hikaru Hashitani. Mechanisms underlying spontaneous constrictions of postcapillary venules in the rat stomach . Pflügers Archiv - European Journal of Physiology, Muscle Physiology, February 2016, Volume 468, Issue 2, pp 279-291.
