作为最简单经济的外源蛋白表达方法,大肠杆菌外源蛋白表达技术深受大众青睐,是最常用的表达方式。但是对小小的细菌而言,这些不速之客—外源蛋白,到底受不受欢迎呢?
有的情况下大肠杆菌对这个不速之客毫不客气,等表达出来结果一看,完全没有目的条带,出现这种情况可能是因为:
①二级翻译起始位点的影响。当基因起始密码子后面有一个与核糖体结合位点(RBS)时,核糖体也会从这个位点开始翻译可能导致截短、移码等。
原核基因的核糖体结合位点SD序列是mRNA起始密码子上游约4~7 bp前的一段富含嘌吟短序列(5’-AGGAGG-3’)。这段序列与16S rRNA 3’端 3’-UCCUCC-5’区段完全互补,帮助16S rRNA识别以及从起始密码子处开始翻译。SD序列越强则基因表达水平越高,SD序列中GGAGG是弱SD序列偏好模式,AAGGA是强SD序列偏好模式,并且同一模式中SD序列距起始密码子的距离不同所起到的调控作用也不同。例如,GGAG模式中碱基A在强SD序列中位于-8位,在弱SD序列中位于-7和-9位。
另外,在真核基因中核糖体会识别Kozak序列并将其作为翻译起始位点。Kozak序列是一段位于起始密码子上下游的模式,为—G/N-C/N-C/N-ANNATGG—的短序列,其中3位的A碱基对翻译效率有着重要影响。根据Kozak规则(见下图),—GCCACCATGG—、—GCCATGATGG—的序列转录和翻译效率最高。所以,真核表达中的引物设计需在ATG前加上—GCCACC—促进目的蛋白的表达。
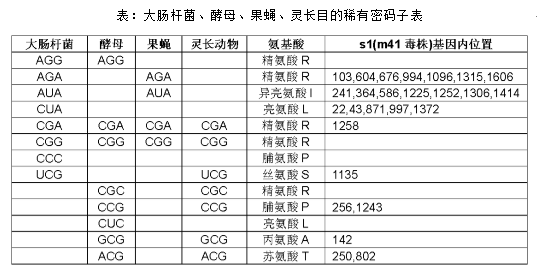
②稀有密码子影响。密码子总共有64种,多数物种不会以相同的频率使用而是有偏爱性地使用其中一部分,我们称某个物种不常用的那些密码子为稀有密码子。例如在大肠杆菌、酵母细胞、果蝇体内表达高丰度蛋白的mRNA序列里表现出某种程度的密码子偏爱。每个物种偏爱的密码子不尽相同,在进行蛋白表达时,外源蛋白基因含有的某些密码子因为不被宿主细胞所偏爱可能会导致表达效率低下。
在翻译过程中,核糖体在稀有密码子组成的mRNA上的移动速率比不含稀有密码子的慢,成簇的稀有密码子则会抑制核糖体的移动。当稀有密码子簇位于mRNA的3’端或5’端时均会显著降低蛋白的表达水平,散在分布的稀有密码子对蛋白翻译的影响则有负面效应。在大肠杆菌外源蛋白表达中,某些外源基因本身含有较多稀有密码子,在起始密码子后15 bp内的稀有密码子会对蛋白表达有着显著的影响,可以使用基因合成的方式进行密码子优化,不过这种方法对原核宿主内表达蛋白有较好的效果,却对真核宿主的影响不大,只能起到锦上添花的效果。
③mRNA二级结构的影响。如果基因序列里存在与核糖体结合位点和/或翻译起始位点互补的序列,则转录形成的mRNA可能会形成二级结构,导致翻译停止。可以采用同义密码子替换的方式进行优化,即采用基因合成的方式进行优化,提高目的蛋白的表达量。
④GC含量的影响。众所周知,GC含量在PCR反应中是一个重要指标。除此之外,基因的GC含量也影响着转录出的mRNA热力学稳定性及二级结构,如果表达序列中GC含量超过70%则可能会导致蛋白在大肠杆菌中表达水平降低。
⑤转录终止子的影响。转录终止子可以促进蛋白的表达,缺少时就会造成“通读”,也就是转录一直进行下去。在pET系列载体里目的基因的反方向有一个选择性标记基因防止目的基因转录时发生“通读”,要是目的基因的方向与这个标记基因方向一致(不同的载体标记基因的方向是不一定的)而且后面没有一个终止子,那么目的基因就会和标记基因在转录过程中不断竞争生成mRNA,可能会降低目的蛋白的表达量。
⑥mRNA的稳定性。大肠杆菌细胞内mRNA稳定性并不高,如果在mRNA 5’-非翻译区和3’-rho非依赖性终止子处插入稳定结构序列,则可以起到增强mRNA稳定性的作用。例如mRNA 5’端的不带突出的发夹结构能通过延长mRNA半衰期使其稳定性大大增加。
⑦翻译终止效率。翻译终止效率对蛋白的表达量有很大的影响,更有效的翻译终止可以促进蛋白表达。绝大多数生物都有偏爱的围绕终止密码子的序列框架。例如,酵母和哺乳动物偏爱的终止密码子分别是UAA和UGA,单子叶植物最常利用UGA,而昆虫和大肠杆菌倾向于用UAA。大肠杆菌里终止密码子序列—UAA(U)—可使翻译效率达80%,而—UGA(C)—序列则只有7%。
有的情况下大肠杆菌对这个不速之客比较友好,但是却把目的蛋白变成了包涵体而不是可溶形式在细胞里活蹦乱跳。包涵体是何方神圣?原来当外源基因在原核细胞中尤其是大肠杆菌中高效表达时,会聚集形成由膜包裹的高密度、不溶性颗粒,成分包括50%以上的重组蛋白及核糖体元件、RNA聚合酶、外膜蛋白ompC、ompF和ompA等,包括环状或缺口的质粒DNA,以及脂体、脂多糖等形式。这些颗粒的形成原因主要有以下几种:
①表达量过高。当蛋白的合成速度过快,会使蛋白来不及正确折叠及形成正确的二硫键,加上包涵体的形成也能降低胞内外源蛋白的浓度更促进了包涵体的形成。所以某些蛋白在大肠杆菌里表达会形成大量的包涵体,这些过量的蛋白间非特异性结合起来,使得蛋白无法达到足够的溶解度,形成包涵体。
②异源性影响。多数重组蛋白对大肠杆菌而言是异源的,大肠杆菌细胞内缺乏真核细胞翻译后修饰所需的酶类,对某些需要修饰的真核蛋白,其在大肠杆菌里表达出来的蛋白中间体由于未得到及时修饰会大量积累形成沉淀。例如真核糖蛋白由于无法糖基化使得中间体聚集形成包涵体。
③分泌信号肽的影响。某些重组蛋白的分泌信号肽也会影响蛋白的折叠,它可能会使蛋白折叠成一个错误的构象导致错误折叠分子的产生,降低了蛋白的溶解度。
④蛋白氨基酸组成。通常蛋白序列里含硫氨基酸比例越高则越容易形成包涵体,而脯氨酸(Pro)的比例也明显与包涵体的形成呈现正相关。
⑤环境因素。包涵体是由部分变性的中间体聚合而成,所以影响中间体稳定性的各种环境因素都可能导致包涵体的形成。例如大肠杆菌细胞内环境的pH如果接近目的蛋白等电点pI则容易形成包涵体,另外培养基的离子强度不合适、培养温度过高等因素也可能引起中间体的聚合反应形成包涵体。
因此,在表达外源蛋白之前,要对目的基因及目的蛋白进行各方面的分析,选择合适的表达载体、表达条件,才能得到理想的蛋白。
如何低成本研究空间转录组?看完这篇文章你或许会有答案
(2022-06-02T14:51 浏览数:5537)
【周二晚八点】从位置到功能--空间转录组应用
(2022-05-16T08:59 浏览数:6327)
Cell Reports:利用空间转录组解析哺乳动物精子生成
(2022-04-28T14:54 浏览数:7417)
RNA二级结构调控基因表达的研究现状和进展
(2022-04-21T13:39 浏览数:5460)
Nature: MERFISH绘制小鼠初级运动皮层空间细胞图谱
(2022-04-18T13:24 浏览数:4208)
大自然的恩赐-外泌体药载
(2022-04-08T13:43 浏览数:5788)
【详解】基于图像的单细胞空间分辨转录组学技术
(2022-04-01T11:18 浏览数:9767)
知无不“研”,五分钟带你了解空间分辨转录组学的前世今生
(2022-03-18T14:00 浏览数:6558)
唾液外泌体与临床疾病的关联研究
(2022-03-11T16:36 浏览数:5052)
唾液外泌体与临床疾病的关联研究
(2022-03-11T16:36 浏览数:5565)